A + B  C + D
C + D
Reagentes Produtos
O conhecimento e o estudo das reações, além de ser muito importante em termos industriais, também estão relacionados ao nosso dia-a-dia.
A velocidade de uma reação é a rapidez com que os reagentes são consumidos ou rapidez com que os produtos são formados. A combustão de uma vela e a formação de ferrugem são exemplos de reações lentas. Na dinamite, a decomposição da nitroglicerina é uma reação rápida.
As velocidades das reações químicas são determinadas através de leis empíricas, chamadas leis da velocidade, deduzidas a partir do efeito da concentração dos reagentes e produtos na velocidade da reação.
As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas, porque além da concentração de reagentes e produtos, as velocidades das reações dependem também de outros fatores como:
Concentração de reagentes: quanto maior a concentração dos reagentes maior será a velocidade da reação. Para que aconteça uma reação entre duas ou mais substâncias é necessário que as moléculas se choquem, de modo que haja quebra das ligações com conseqüente formação de outras novas. O número de colisões irá depender das concentrações de A e B. Veja a figura:
As velocidades das reações químicas são determinadas através de leis empíricas, chamadas leis da velocidade, deduzidas a partir do efeito da concentração dos reagentes e produtos na velocidade da reação.
As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas, porque além da concentração de reagentes e produtos, as velocidades das reações dependem também de outros fatores como:
Concentração de reagentes: quanto maior a concentração dos reagentes maior será a velocidade da reação. Para que aconteça uma reação entre duas ou mais substâncias é necessário que as moléculas se choquem, de modo que haja quebra das ligações com conseqüente formação de outras novas. O número de colisões irá depender das concentrações de A e B. Veja a figura:
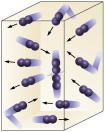
Moléculas se colidem com maior freqüência se
aumentarmos o número de moléculas reagentes.
É fácil perceber que devido a uma maior concentração haverá aumento das colisões entre as moléculas.
Superfície de contato: um aumento da superfície de contato aumenta a velocidade da reação. Um exemplo é quando dissolvemos um comprimido de sonrisal triturado e ele se dissolve mais rapidamente do que se estivesse inteiro, isto acontece porque aumentamos a superfície de contato que reage com a água.
Pressão: quando se aumenta a pressão de um sistema gasoso, aumenta-se a velocidade da reação.
Superfície de contato: um aumento da superfície de contato aumenta a velocidade da reação. Um exemplo é quando dissolvemos um comprimido de sonrisal triturado e ele se dissolve mais rapidamente do que se estivesse inteiro, isto acontece porque aumentamos a superfície de contato que reage com a água.
Pressão: quando se aumenta a pressão de um sistema gasoso, aumenta-se a velocidade da reação.

Um aumento na pressão de P1 para P 2 reduziu o volume de V1 para V1/2, acelerando a reação devido à aproximação das moléculas.
A figura acima exemplifica, pois com a diminuição do volume no segundo recipiente, haverá um aumento da pressão intensificando as colisões das moléculas e em conseqüência ocorrerá um aumento na velocidade da reação.
Temperatura: quando se aumenta a temperatura de um sistema, ocorre também um aumento na velocidade da reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas. No nosso dia-a-dia podemos observar esse fator quando estamos cozinhando e aumentamos a chama do fogão para que o alimento atinja o grau de cozimento mais rápido.
Catalisadores: os catalisadores são substâncias que aceleram o mecanismo sem sofrerem alteração permanente, isto é, durante a reação eles não são consumidos. Os catalisadores permitem que a reação tome um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe mais rapidamente. É importante lembrar que um catalisador acelera a reação mais não aumenta o rendimento, ou seja, ele produz a mesma quantidade de produto, mas num período de menor tempo.
Temperatura: quando se aumenta a temperatura de um sistema, ocorre também um aumento na velocidade da reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas. No nosso dia-a-dia podemos observar esse fator quando estamos cozinhando e aumentamos a chama do fogão para que o alimento atinja o grau de cozimento mais rápido.
Catalisadores: os catalisadores são substâncias que aceleram o mecanismo sem sofrerem alteração permanente, isto é, durante a reação eles não são consumidos. Os catalisadores permitem que a reação tome um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe mais rapidamente. É importante lembrar que um catalisador acelera a reação mais não aumenta o rendimento, ou seja, ele produz a mesma quantidade de produto, mas num período de menor tempo.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Graduada em Química
Equipe Brasil Escola






























